三阴性乳腺癌(TNBC)是指乳腺癌中激素受体(ER和PR)表达阴性同时HER2受体表达阴性(IHC 1+/0)的亚型,具有侵袭性强、预后差的特点。尽管目前化疗仍是三阴性乳腺癌的主要治疗手段,但是各种新型药物在TNBC中已经做出了大量尝试,有些也取得了重要突破。免疫治疗和靶向治疗是近年来TNBC中值得关注的新疗法。
IMpassion130是一项评估atezolizumab(T药)联合白蛋白紫杉醇对比安慰剂联合白蛋白紫杉醇,在一线治疗转移性三阴性乳腺癌中的疗效和安全性的III期临床试验。该研究结果表明,表达PD-L1的患者可以从该联合治疗中获益[1];NCCN指南推荐该联合用药方案作为PD-L1≥1%的晚期TNBC患者的优选方案。
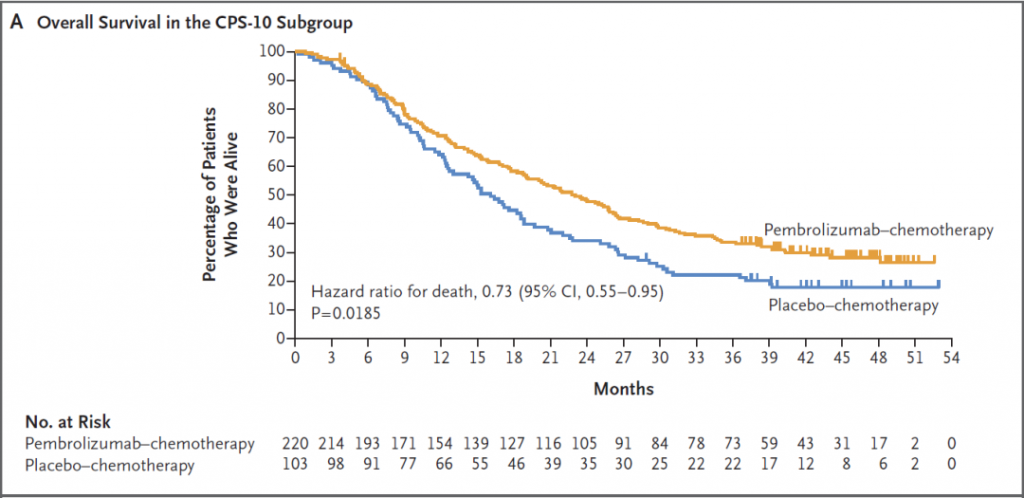
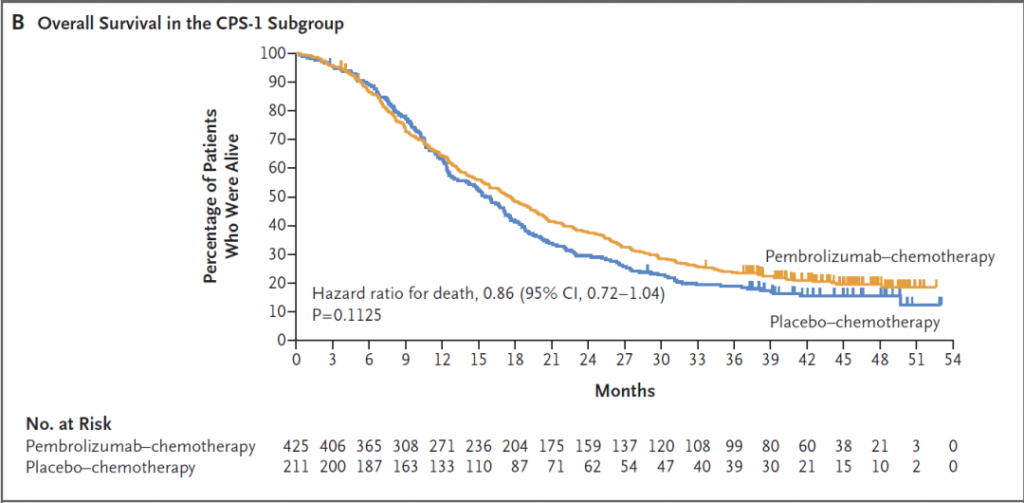
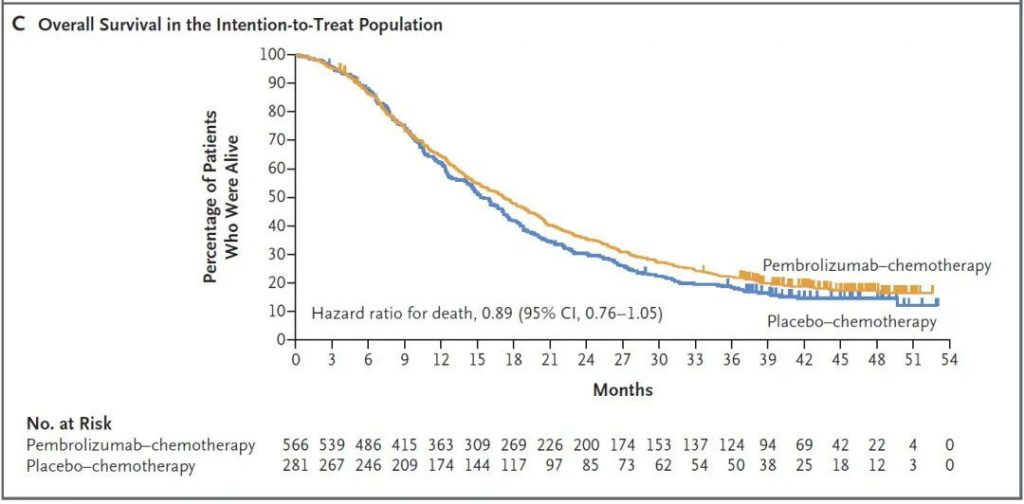
KEYNOTE-355是评估pembrolizumab(K药)联合化疗对比安慰剂联合化疗,在既往未经治疗的局部复发、不可手术或转移性三阴性乳腺癌中的疗效和安全性的III期临床试验。研究结果表明,帕博利珠单抗联合化疗在CPS≥10的患者群体中显著提高了OS(23月vs16.1月, HR=0.73)[2]。目前NCCN指南推荐该联合方案(帕博利珠单抗联合白紫/紫杉醇/吉西他滨和卡铂)作为CPS≥10的TNBC患者的优选一线方案。
国内近年来也在TNBC的免疫治疗领域取得。复旦大学附属肿瘤医院邵志敏教授团队提出 “复旦分型”,将三阴性乳腺癌分为4个亚型:免疫调节型、腔面雄激素受体型、基底样免疫抑制型和间质型[3]。他们发现免疫调节型患者接受免疫治疗后的疗效更好[4]。
之后他们又开展了一项含免疫治疗的三药联合方案一线治疗既往未接受过系统治疗的无法切除、局部晚期或转移性免疫调节型TNBC患者中的II期临床研究。最新结果报道卡瑞利珠单抗+法米替尼+白紫的一线治疗的客观缓解率高达81.3%,中位无进展生存期(PFS)为13.6个月,且安全性可控[5]。
据报道,约5.5%-9.1%的中国乳腺癌患者携带BRCA1/2基因的致病/可能致病突变,其中BRCA1基因突变与患TNBC风险高度相关。PARP抑制剂通过合成致死原理诱导肿瘤细胞的凋亡。基于两项三期临床试验的结果,NCCN指南推荐,所有复发或转移的乳腺癌患者接受BRCA1/2基因检测,并支持携带BRCA基因致病/可能致病的胚系突变的乳腺癌患者(不论亚型)接受奥拉帕利和他拉唑帕利治疗。
SG(Sacituzumab Govitecan-hziy)是抗体药物偶联物,由靶向人滋养细胞表面抗原-2(TROP2)的抗体、连接子(Linker)和拓扑异构酶I(TOP1)抑制剂SN-38组成。
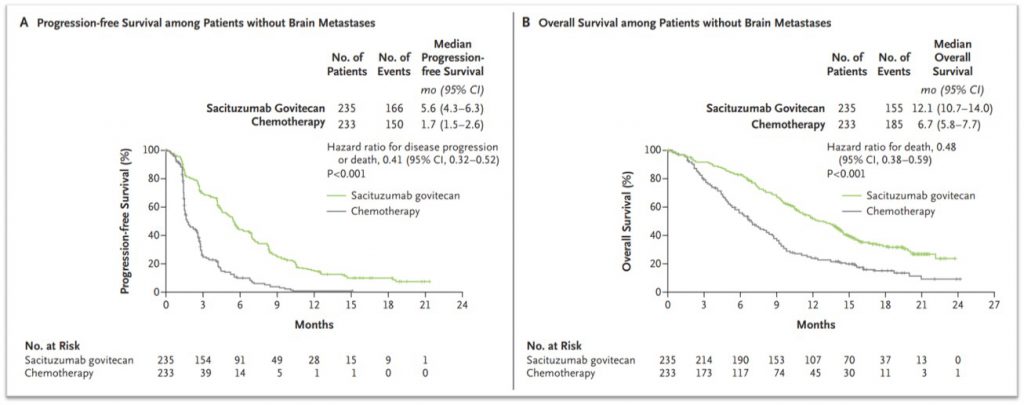
ASCENT是一项在既往至少接受过二线系统治疗的复发或顽固性转移性TNBC患者中开展的评估SG疗效和安全性的III期随机对照研究,与对照组相比,SG组将中位无进展生存期从1.7个月提高到5.6个月,中位总生存期从6.7个月延长到12.1个月[6]。NCCN指南推荐SG作为复发不可切除的,或IV期TNBC患者的系统治疗方案。
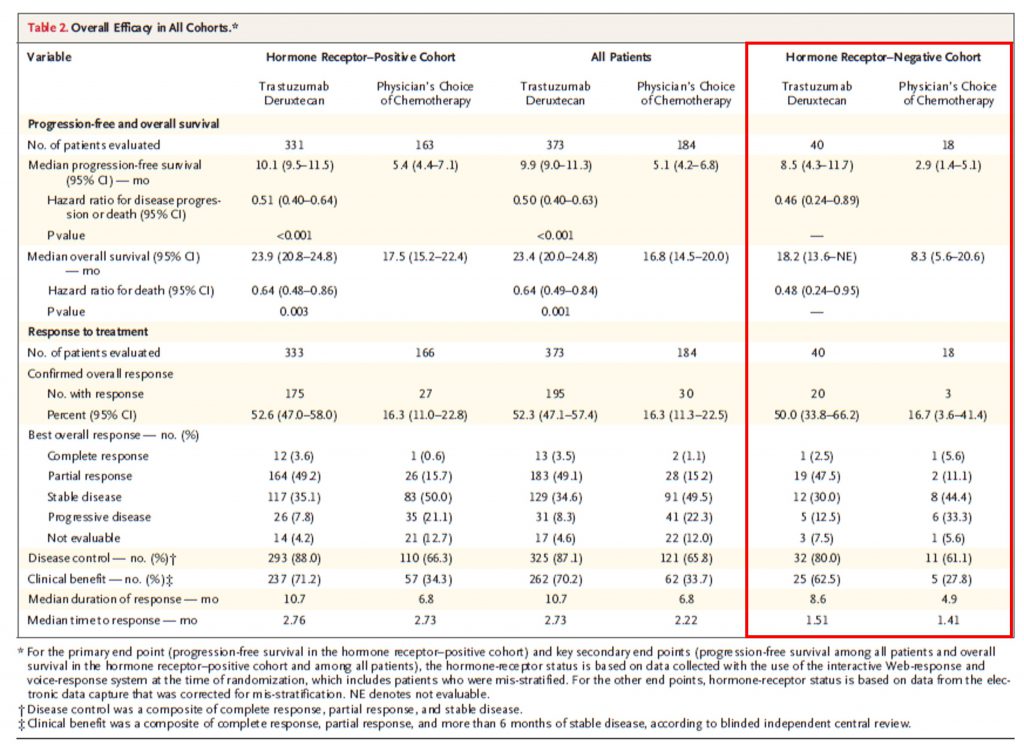
DESTINY-Breast04研究是一项研究T-DXd(DS-8201)在既往接受过一线或二线化疗的转移性HER2低表达乳腺癌患者中的疗效和安全性的III期多中心随机对照研究(N=557)。最新结果表明T-DXd组的中位PFS(9.9月vs 5.1月)和OS(23.4月vs 16.8月)都显著长于化疗组;值得注意是,在58例HR-/HER2低表达患者中T-DXd组的中位PFS(8.5月 vs 2.6 月)和中位OS(23.9月 vs 17.5月)也显著长于化疗组[7]。对于预后极差的TNBC患者来说,T-DXd对PFS和OS的改善,意义尤为重大。
作为精准医疗国际领军企业——慧渡医疗,自主研发出高灵敏度、低样本量要求量的新一代液态活检检测产品。慧渡医疗推出的ctDNA检测产品已经助力北京大学肿瘤医院、美国西北大学等国内外知名机构的乳腺癌研究团队在乳腺癌中开展了大量研究;同时,慧渡医疗与多家跨国药企在乳腺癌抗肿瘤药物开发中开展了多项临床试验上的合作,为ctDNA检测产品服务全球肿瘤患者打下了坚实的基础。
点击查看往期相关链接:
*Journal of Translational Medicine|新一代液态活检技术助力晚期乳腺癌患者预后及疗效监控
*Frontiers in Oncology|基于液态活检的乳腺癌胚系基因变异研究助力精准诊疗
*The Breast|新一代液态活检助力临床HER2阳性乳腺癌判断预后
*慧渡医疗媲美Guardant Health,国际著名学者连续两篇文章验证液态活检技术
*乳腺癌研究进展|慧渡医疗携手美国西北大学在国际专业期刊Breast Cancer Research发表专业学术论文
参考文献:
[1] Schmid P, Adams S, Rugo HS, et al. IMpassion130: updated overall survival (OS) from a global, randomized, double-blind, placebo- controlled, Phase III study of atezolizumab (atezo) + nab-paclitaxel (nP) in previously untreated locally advanced or metastatic triple-negative breast cancer (mTNBC). Journal of Clinical Oncology 2019;37:1003- 1003. [2] Cortes J, Rugo HS, Cescon DW, et al. Pembrolizumab plus Chemotherapy in Advanced Triple-Negative Breast Cancer. N Engl J Med. 2022 Jul 21;387(3):217-226. [3] Jiang YZ, Ma D, Suo C, et al. Genomic and Transcriptomic Landscape of Triple-Negative Breast Cancers: Subtypes and Treatment Strategies. Cancer Cell. 2019 Mar 18;35(3):428-440.e5. [4] Gong Y, Ji P, Yang YS, et al. Metabolic-Pathway-Based Subtyping of Triple-Negative Breast Cancer Reveals Potential Therapeutic Targets. Cell Metab. 2021 Jan 5;33(1):51-64. [5] Chen L, Jiang YZ, Wu SY, et al. Famitinib with Camrelizumab and Nab-Paclitaxel for Advanced Immunomodulatory Triple-Negative Breast Cancer (FUTURE-C-Plus): An Open-Label, Single-Arm, Phase II Trial. Clin Cancer Res. 2022 Jul 1;28(13):2807-2817. [6] Bardia A, Hurvitz SA, Tolaney SM, et al. ASCENT Clinical Trial Investigators. Sacituzumab Govitecan in Metastatic Triple-Negative Breast Cancer. N Engl J Med. 2021 Apr 22;384(16):1529-1541. [7] Modi S, Jacot W, Yamashita T, et al.DESTINY-Breast04 Trial Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022 Jul 7;387(1):9-20.
