
2022年美国临床肿瘤学会年会——泌尿生殖系统肿瘤临床研究会议(ASCO-GU22)隆重落下帷幕,慧渡医疗联合澳大利亚Monash大学和美国Mayo clinic发表了最新研究成果,采用PredicineCARE™精准检测DNA损伤修复(DDR)通路的基因变异。
通过分析来自美国和澳大利亚的两个独立队列-累计407例转移去势抵抗型前列腺癌(mCRPC)患者治疗基线血液样本,该研究在业界第一次系统性地描绘了mCRPC中DDR通路基因的突变频谱。临床数据分析显示,携DDR基因变异的患者OS较差,携带BRCA2基因变异的mCRPC患者从AR通路抑制剂治疗中获益性显著低于化疗。本研究证明了慧渡医疗新一代液态活检DDR基因突变检测可以为mCRPC的临床预后判断提供支持。
Abstract #153:Prognostic and predictive utility of DNA damage response (DDR) aberrations detected in cell-free DNA (cfDNA) in metastatic castration-resistant prostate cancer (mCRPC)
合作单位:澳大利亚Monash大学,美国Mayo clinic
mCRPC中DDR基因变异与临床预后的联系尚不明确。在mCRPC中,除PARP抑制剂外,DDR的变异是否与其它疗法的疗效有相关性,目前还知之甚少。随着分子图谱在mCRPC中的应用越来越多,基于液态活检的DDR基因变异监测与临床预后的关联至关重要。
该研究纳入了407名mCRPC患者,分别来自两个国家的独立研究队列(n=162澳大利亚,n=245美国)。采集患者在治疗基线期的外周血,分离并提取血浆游离DNA(cfDNA)及胚系基因组DNA,并通过慧渡医疗PredicineCARE™检测患者携带的基因变异。Kaplan-Meier生存曲线和多变量Cox回归分析用于评估DDR基因变异与临床结果之间的相关性,包括无进展生存期(PSA)、响应率(RR)、和总生存期(OS)。
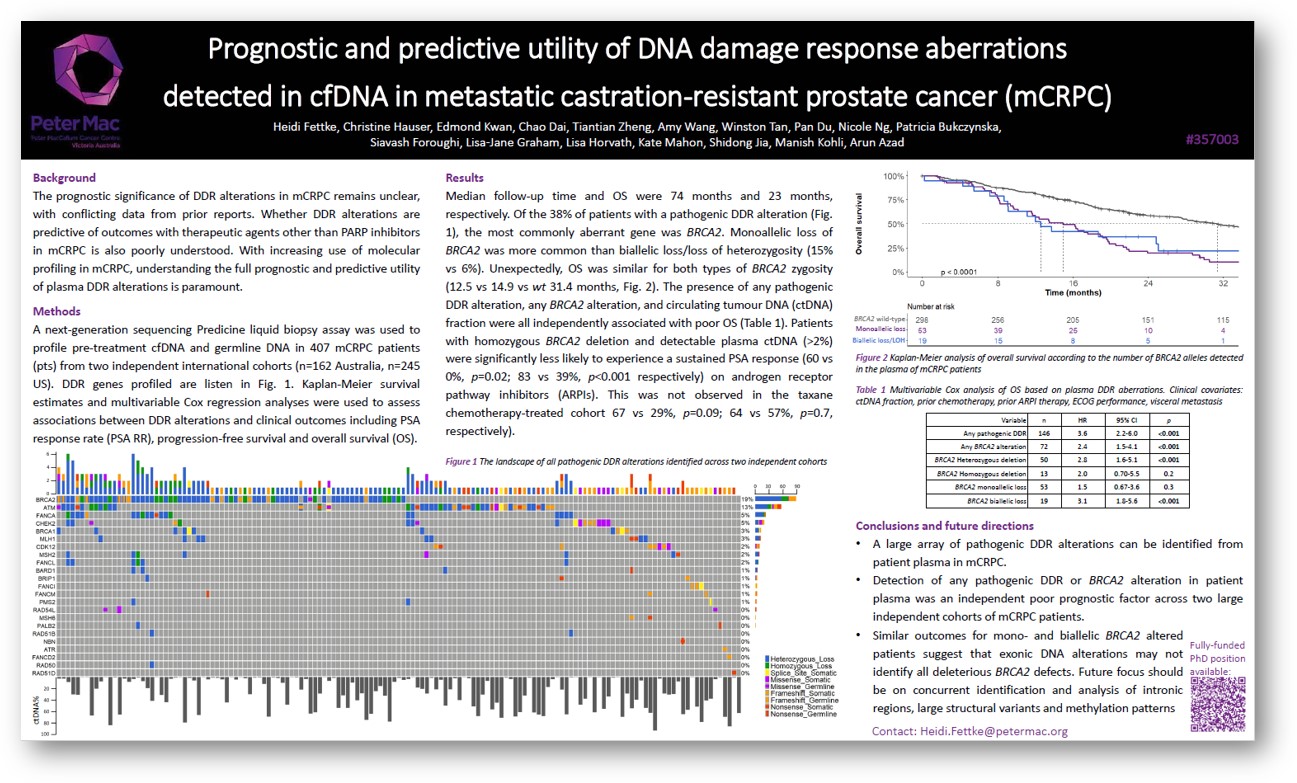
结果显示:患者整体的中位随访时间和总生存期(OS)分别为74个月和23个月。患者基线突变图谱显示,其中38%的患者携带具有致病性DDR基因变异,最常见的变异基因是BRCA2。
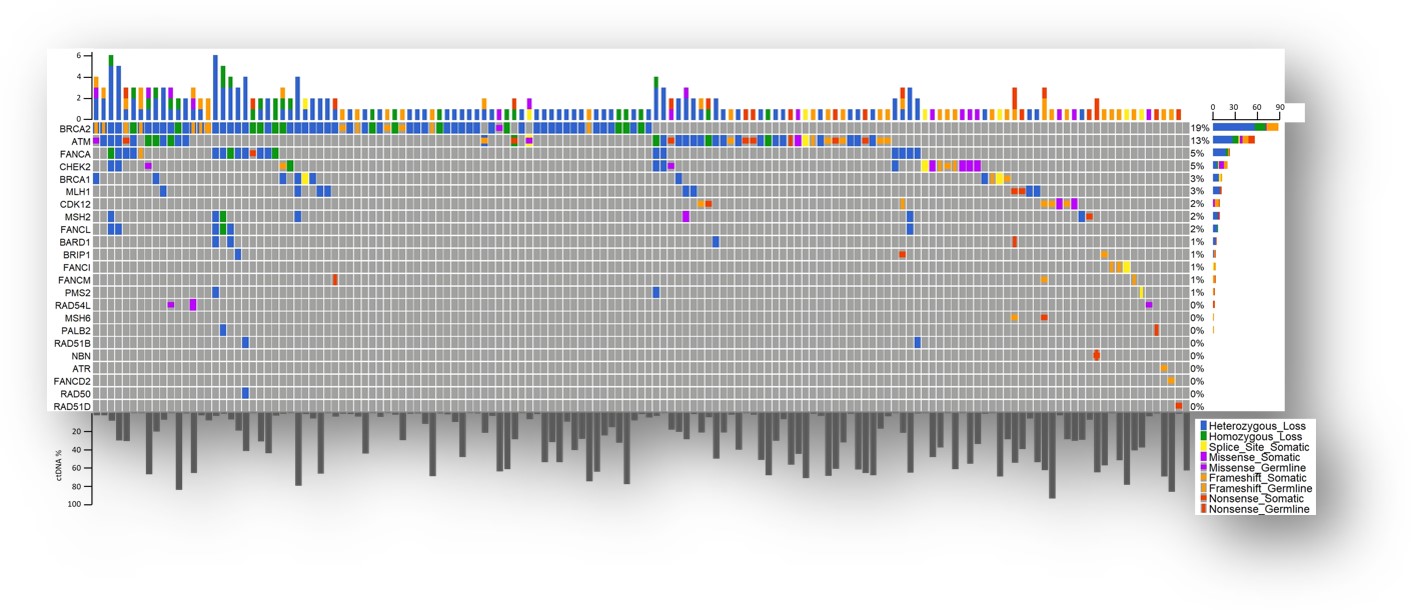
在所有BRCA2的杂合性缺失类型中,单等位基因缺失比双等位基因缺失的占比更高(15%对6%)。但是,不同类型BRCA2缺失的患者在OS上无显著差异(12.5个月vs 14.9个月,野生型为31.4个月)。DDR通路上的致病性变异、BRCA2变异和循环肿瘤DNA(ctDNA)含量均各自与较差的OS相关。
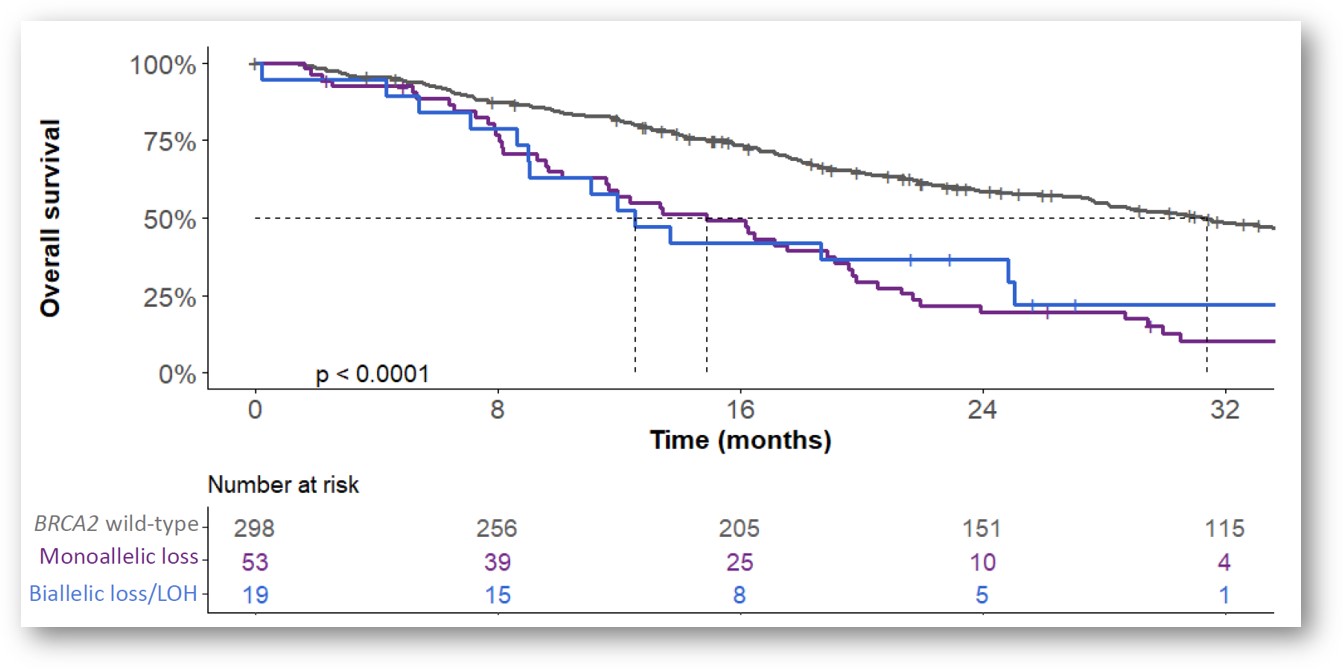
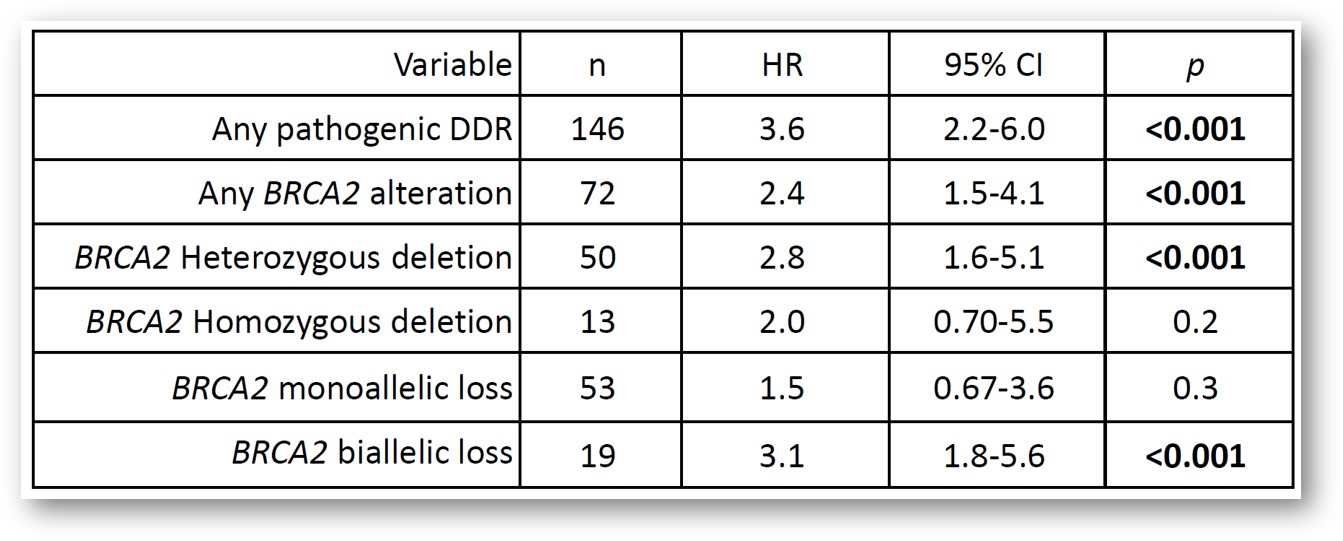
经由PSA水平变化判断,BRCA2纯合性缺失以及ctDNA检出阳性(>2%)的接受AR通路抑制剂治疗的患者不易出现临床响应(BRCA2纯合缺失:60% vs 0%,p=0.02;ctDNA阳性:83% vs 39%,p<0.001)。在紫杉烷化疗组患者中未观察显著差异(BRCA2纯合缺失:67% vs 29%,p=0.09;ctDNA阳性:64% vs57%,分别为p=0.7)。
慧渡医疗新一代液态活检ctDNA检测可以精确刻画mCRPC患者携带的致病性DDR基因变异。经不同的mCRPC队列验证,外周血中检出的致病性DDR基因变异以及BRCA2基因变异是不良预后因素。BRCA2单等位和双等位基因缺陷患者的结果无显著差异,意味着DNA外显子改变可能无法识别所有有害的BRCA2缺陷。未来的重点应该是同时识别和分析内含子区域、染色质水平的结构变异和甲基化模式。
目前慧渡医疗与全球前十名的国际药企进行临床合作研究,多篇文章发表在European Urology 等影响因子达20分的国际顶级学术期刊。通过全球范围的合作,慧渡医疗基于尿液、血液和组织的新一代基因检测技术在新药临床试验、个体化医疗和癌症早筛等领域发挥了积极作用,通过建立智慧医学大数据平台赋能精准医疗。慧渡医疗助力肿瘤新药创新,引领泌尿生殖系统肿瘤的精准新药开发。
慧渡医疗立足中国上海,业务辐射全球。在美国硅谷设立北美CLIA和CAP双认证的实验室,在新加坡成立了亚洲商业运营中心;中国北京公司聚焦CDx报批,苏州公司专注于生信研发和BD;德国Berlin和美国Boston启动欧美商业运营中心。
