今年4月份以来,两大监管机构FDA、ESMO以及癌症非盈利组织癌症研究之友(Friends of Cancer Research)陆续就ctDNA在实体瘤临床实践中的应用发布了指导意见。这三份指导意见都肯定了ctDNA动态监测作为药物疗效指示和临床试验早期终点的潜力,同时也指出了目前仍然存在的一些问题,如ctDNA检测产品的性能差异以及临床试验设计的差异等,因此各指导意见均认为还需要更多支持ctDNA变化能够与患者的生存数据(DFS/EFS/OS)和临床响应相关性的证据。下面,我们以三个已发表的研究来探讨ctDNA变化作为临床试验早期终点的研究现况和未来趋势:

IMvigor010(NCT02450331)是一项探究与对照组(仅观察,不予任何处理)相比,接受了切除术的尿路上皮癌患者能否从atezolizumab一线辅助治疗中获益的III期临床研究,结果显示在atezolizumab组和对照组间不存在显著差异。基于该研究纳入的患者,Powles等人分析了其中581例患者在基线和随机分组后第六周血浆中的游离DNA的突变情况,其中214例(37%)患者为基线ctDNA阳性,包括116例接受atezolizumab辅助治疗的患者和98例观察组的患者。他们发现基线ctDNA阳性的患者中,atezolizumab辅助治疗组的mDFS和OS都显著长于观察组,而在基线阴性患者中,无论mDFS还是OS都没有显著差异;atezolizumab组中的ctDNA清除率(基线ctDNA阳性第六周ctDNA降为0)显著高于观察组,且atezolizumab组中ctDNA完全清除的患者的DFS和OS都显著长于ctDNA未完全清除的患者,提示血浆ctDNA完全清除可以作为预测atezolizumab辅助治疗疗效的生物标志物[1]。
I-SPY 2 TRIAL(NCT01042379)是一项评估标准化疗(NAC)联合/不联合AKT抑制剂在高风险II/III乳腺癌患者中作为新辅助治疗方案的疗效和安全性的多中心II期临床研究。Magbanua等人回顾性分析了其中84例接受新辅助治疗的患者在不同时间点的血浆样本:新辅助治疗前(T0)、紫杉醇治疗3周后(T1)、紫杉醇和蒽环类药物治疗期间(T2)和手术前(T3)。他们发现ctDNA阳性患者的比例在T0、T1、T2和T3时分别是73%、35%、14%和9%,在T1时间点ctDNA阳性的患者新辅助化疗结束后未获得完全缓解的比例显著高于T1时ctDNA完全清除的患者;新辅助化疗结束后获得完全缓解的患者在T3时间点都是ctDNA阴性,且DFS更长,而未获得完全缓解的患者中,ctDNA阳性患者的远处复发风险增加[2]。
在AstraZeneca开展的一项探究标准化疗联合ICIs(德瓦鲁单抗和/或替西木单抗)一线治疗晚期胆道肿瘤患者的开放标签、单臂、II期临床研究中(点击查看原文),使用慧渡医疗自主开发的PredicineATLAS™ cfDNA 600产品进行检测,同样证实在胆道肿瘤中,血浆ctDNA水平下降与化疗联合免疫的疗效相关[3]。
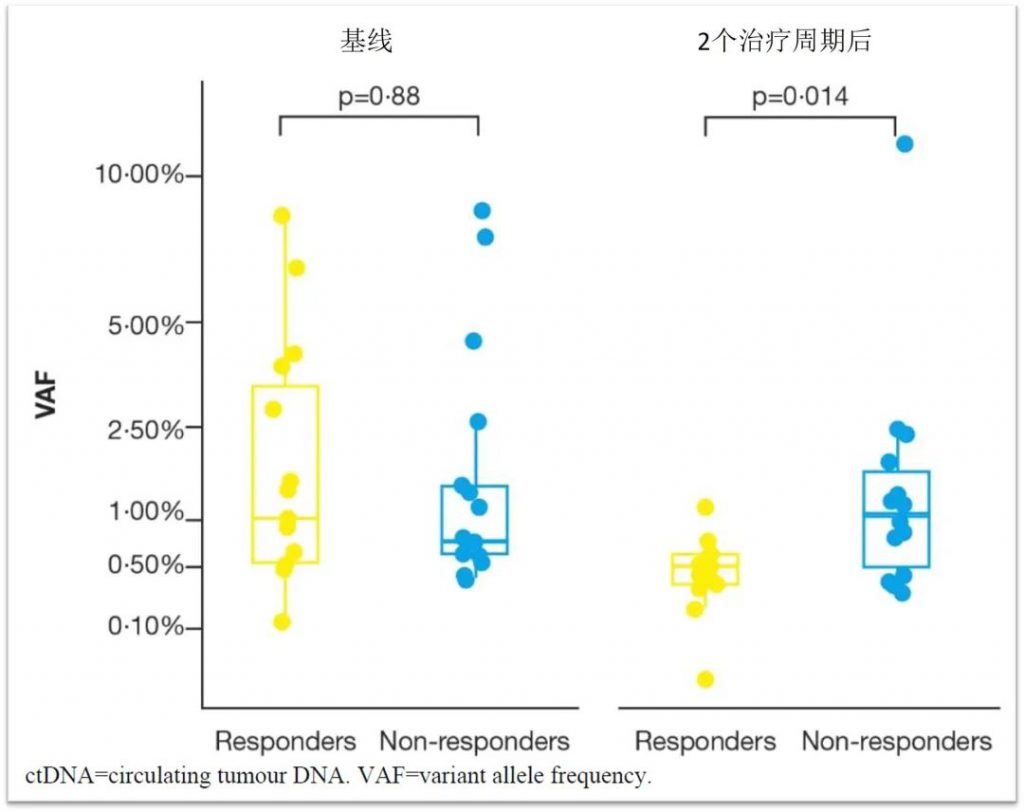
以上研究都表明患者在药物治疗过程中的ctDNA动态变化与疗效具有相关性,但是也暴露了尚待明确的一些细节问题,如:基于ctDNA的缓解应该如何定义(是ctDNA完全清除还是下降?),ctDNA检测的时间点应如何确立(化疗一个疗程后,还是两个疗程后?)等等。值得注意的是,三份指导意见都强调了ctDNA检测产品检测性能的重要性,选择一款性能可靠的ctDNA检测产品则是第一步。
作为精准医疗国际领军企业——慧渡医疗,针对外周血开发了多款基因检测产品,具有灵敏度高和样本要求量低的优势。慧渡医疗的PredicineATLAS™ cfDNA 600产品在知名药企BMS对5款国际顶尖液态活检产品开展的性能测试比较中脱颖而出(点击查看原文)。PredicineBEACON™是一款可以在没有肿瘤组织的情况下,采用血浆或尿液作为基线样本,实现个性化MRD检测的基因检测产品,该产品已应用于国际顶尖药企的重磅临床试验,并很好的评估了临床试验患者对药物的响应。该研究结果发表于ESMO 2022(点击查看原文)。
目前,慧渡医疗已经与上海仁济医院、梅奥诊所、莫纳什大学等知名机构,以及罗氏、阿斯利康、BMS等知名药企开展了多项合作研究,为将来慧渡医疗ctDNA检测产品服务全球肿瘤患者打下了坚实的基础。
参考文献:
[1] Powles T, Assaf ZJ, Davarpanah N, et al. ctDNA guiding adjuvant immunotherapy in urothelial carcinoma. Nature. 2021 Jul;595(7867):432-437. doi: 10.1038/s41586-021-03642-9. Epub 2021 Jun 16. PMID: 34135506. [2] Magbanua MJM, Swigart LB, Wu HT, et al. Circulating tumor DNA in neoadjuvant-treated breast cancer reflects response and survival. Ann Oncol. 2021 Feb;32(2):229-239. doi: 10.1016/j.annonc.2020.11.007. Epub 2020 Nov 21. PMID: 33232761. [3] Oh DY, Lee KH, Lee DW, et al. Gemcitabine and cisplatin plus durvalumab with or without tremelimumab in chemotherapy-naive patients with advanced biliary tract cancer: an open-label, single-centre, phase 2 study. Lancet Gastroenterol Hepatol. 2022 Jun;7(6):522-532. doi: 10.1016/S2468-1253(22)00043-7. Epub 2022 Mar 9. PMID: 35278356.