上尿路尿路上皮癌(Upper Urinary Tract Urothelial Cell Carcinoma,UTUC)主要是指起源于肾盏、肾盂或输尿管的尿路上皮癌,包括肾盂癌和输尿管癌。在欧美人群中,UTUC约占全部尿路上皮癌的5%-10%;在中国人群中,这一比例略高,约为9.3%-29.9%[1]。有研究报道林奇综合征患者患UTUC的风险增加[2,3]。
目前,根治性肾输尿管切除术仍是非转移性UTUC治疗的金标准,术后行预防性膀胱灌注化疗可有效降低膀胱癌的发生率。对于转移性UTUC,指南推荐一线治疗首选含铂化疗。根据患者对顺铂的耐受情况,可以分成可耐受顺铂和不可耐受的患者,具体推荐方案及推荐级别见表[4]。与膀胱尿路上皮癌相同,CSCO指南也推荐一线化疗后客观有效或稳定的转移性UTUC患者选择阿维鲁单抗(II级推荐)或帕博利珠单抗(III级推荐)进行维持治疗[4]。转移性UTUC的后线治疗方案也同样参考膀胱尿路上皮癌,具体可参考指南[4]。

目前针对UTUC患者开展的临床研究较为有限,以下是我们甄选的近期在国际上开展的几项重要临床研究:
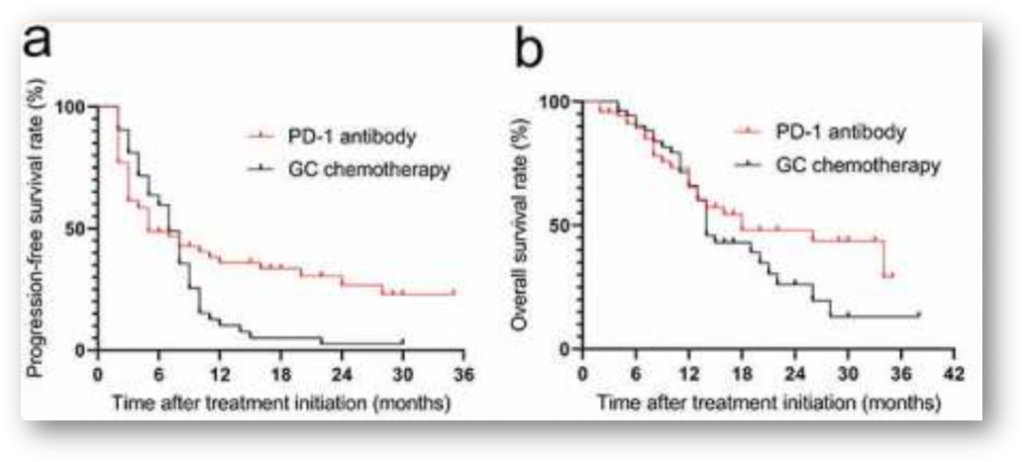
- 转移性UTUC:在上海交通大学医学院附属仁济医院开展的一项回顾性研究中,研究者们比较了卡铂联合化疗和免疫治疗在一线不可耐受顺铂的UTUC患者中的疗效。该项研究收集了123例顺铂不可耐受患者,包括70例接受PD-1抑制剂治疗的患者和53例接受吉西他滨联合卡铂化疗的患者。结果显示,PD-1抑制剂组与吉西他滨联合卡铂化疗组的客观缓解率并没有显著差别(38.6% vs 41.5%)。PD-1抑制剂组和吉西他滨联合卡铂组的中位无进展生存期分别是5.0个月和7.0个月(HR=0.74,95% CI:0.485-1.132,p=0.166),中位总生存时间分别是18个月和14个月,也没有显著差异(HR=0.73,95% CI:0.426-1.256,p=0.257)。值得注意的是,PD-1抑制剂组的缓解持续时间(DOR)显著长于吉西他滨联合卡铂组(中位DOR:NR vs 9个月,p<0.001),并且PD-1抑制剂组的治疗相关不良事件发生率低于卡铂化疗组(57.1% vs. 77.3%)[8],提示PD-1抑制剂用于一线不可耐受顺铂的UTUC患者的治疗时的安全性优于卡铂联合化疗。
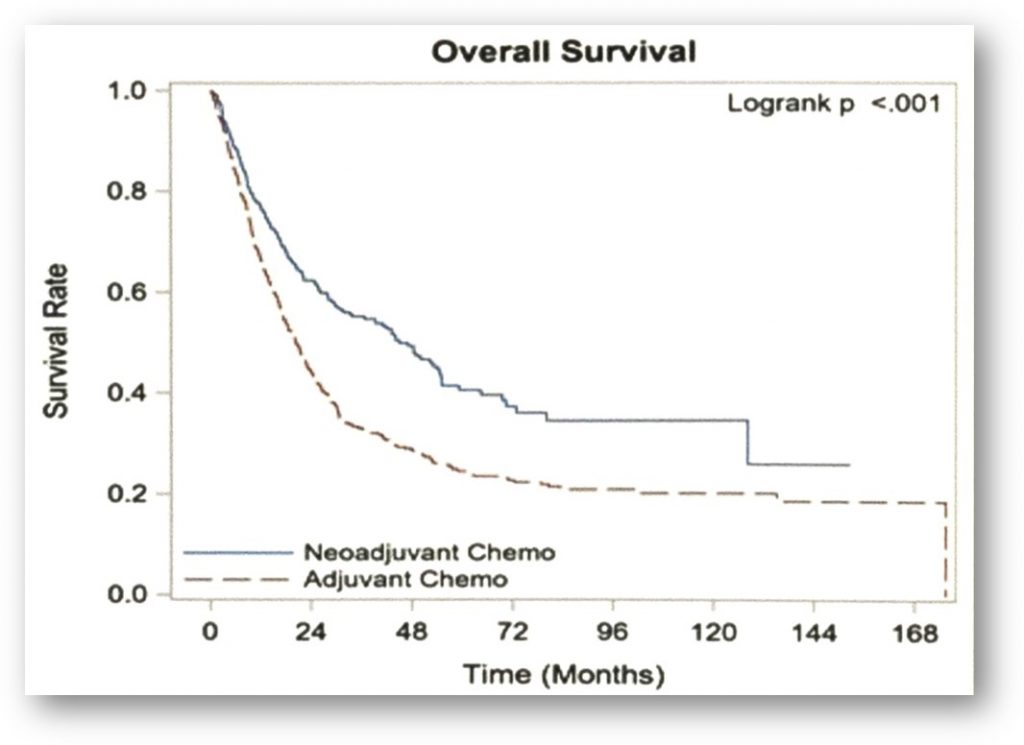
- 非转移性UTUC新辅助治疗:在今年的ASCO-GU大会上,纪念斯隆-凯特琳癌症中心(MSK)公布了一项小样本研究的结果,在9例接受纳武单抗联合伊匹单抗新辅助治疗的顺铂不可耐受的UTUC患者中,3例患者达到病理的完全缓解[5]。在上海交通大学医学院附属仁济医院开展的一项开放标签的II期单臂临床研究中,研究者探究了新辅助免疫治疗在中国UTUC人群中的疗效。纳入患者为不可耐受顺铂化疗的cT3-T4期非转移性UTUC患者。在早期入组且已完成替雷利珠单抗新辅助治疗的12例患者中,10例患者接受了根治性手术。新辅助治疗后1例患者达到影像学完全缓解,3例达到部分缓解,另有5例患者疾病稳定;3例患者达到病理完全缓解[6]。此外,在今年的ASCO-GU大会上,来自纽约罗斯维尔公园综合癌症中心公布了一项大样本回顾研究的结果,比较了新辅助化疗和辅助化疗对局部晚期UTUC患者总生存时间(OS)的影响。结果发现,与辅助化疗相比,新辅助化疗显著降低了患者的死亡率,接受辅助化疗的患者的OS显著短于新辅助化疗患者的OS[7]。
值得注意的是,虽然非转移期UTUC的新辅助治疗有重要临床价值,但UTUC术前临床分期的准确性欠佳,从而导致新辅助化疗的应用受限。面对这一临床痛点,慧渡医疗联合美国Moffitt癌症中心,在2022年ASCO-GU22学术大会上发表最新研究成果,采用慧渡医疗新一代液态活检PredicineCARE™检测上尿路上皮癌(UTUC)患者的组织及血浆游离DNA配对样本,结合临床数据分析,发现精准的液态活检可以预测该患者的临床分期(敏感性71.4%,特异性100%)。这一研究成果为UTUC的精准分期提供重要数据,具有极高的临床应用价值(点击查看原文)。

作为新一代液态活检精准医疗国际领军企业——慧渡医疗,针对外周血和尿液开发的靶向用药和MRD检测产品,具有灵敏度高和样本量要求低的优势。慧渡医疗系列基因检测产品获得国际最权威的美国FDA突破性医疗器械(BDD)认定(点击查看原文)、欧盟CE认证和英国UKCA认证(点击查看原文),这是国际权威监管机构对慧渡医疗技术、产品和其临床应用价值的认可。慧渡医疗新一代液态活检系列产品正被应用于全球排名前10的顶尖药企、美国哈佛大学等国际顶级学术机构开展的众多临床研究,推动国内、国际药企合作伙伴国际多中心临床试验、全球CDx伴随诊断开发和临床诊疗。
参考文献:
[1] 黄健,王建业,孔垂泽,等. 中国泌尿外科和男科疾病诊断治疗指南2021. [2] Metcalfe MJ, Petros FG, Rao P, et al. Universal Point of Care Testing for Lynch Syndrome in Patients with Upper Tract Urothelial Carcinoma. J Urol. 2018 Jan;199(1):60-65. [3] Carlo MI, Ravichandran V, Srinavasan P, et al. Cancer Susceptibility Mutations in Patients With Urothelial Malignancies. J Clin Oncol. 2020 Feb 10;38(5):406-414. [4] CSCO尿路上皮癌诊疗指南(2022). [5] J Clin Oncol 41, 2023 (suppl 6; abstr#511). [6] 黄吉炜,2022年CUDA年会. [7] J Clin Oncol 41, 2023 (suppl 6; abstr#486). [8] Huang J, Su R, Chen Z, et al. The efficacy and safety of first-line treatment in cisplatin-ineligible advanced upper tract urothelial carcinoma patients: a comparison of PD-1 inhibitor and carboplatin plus gemcitabine chemotherapy. Oncoimmunology. 2022 Sep 17;11(1):2124691.