
NCT03046862研究是一项由AstraZeneca(阿斯利康)发起的,在晚期胆道肿瘤患者中开展,旨在探究标准化疗联合免疫治疗作为一线治疗方案安全性和疗效的开放性、单臂、II期临床研究。该研究采用的免疫疗法为阿斯利康开发的PD-L1抑制剂Durvalumab(英飞凡,德瓦鲁单抗)联合CTLA-4抑制剂Tremelimumab(替西木单抗)。相关研究结果近期发表在国际顶级医学杂志Lancet的子刊THE LANCET Gastroenterol & Hepatol。
在这项研究中,慧渡医疗与阿斯利康全球团队继续多年来的深度合作,利用慧渡医疗的600基因PredicineATLAS™液态活检平台对患者肿瘤进行基于血液的无创伤分子生物标志物研究。

该临床试验共纳入了128例无法切除或复发的胆道肿瘤(包括肝内胆管癌、肝外胆管癌、胆囊癌、胆胰/肠道壶腹癌)患者。所有患者分为三组,包括:32位患者接受标准化疗方案序贯标准化疗联合英飞凡和替西木单抗(C/C+D+T组);49位患者接受化疗联合英飞凡治疗方案(C+D组);47位患者接受化疗联合英飞凡联合替西木单抗治疗方案(C+D+T组)。以上方案中的化疗剂量都是1000mg/m2吉西他滨+25 mg/m2顺铂。患者入组情况如图所示。主要研究终点是客观缓解率、次要终点包括疾病控制率、缓解时间和无进展生存期。
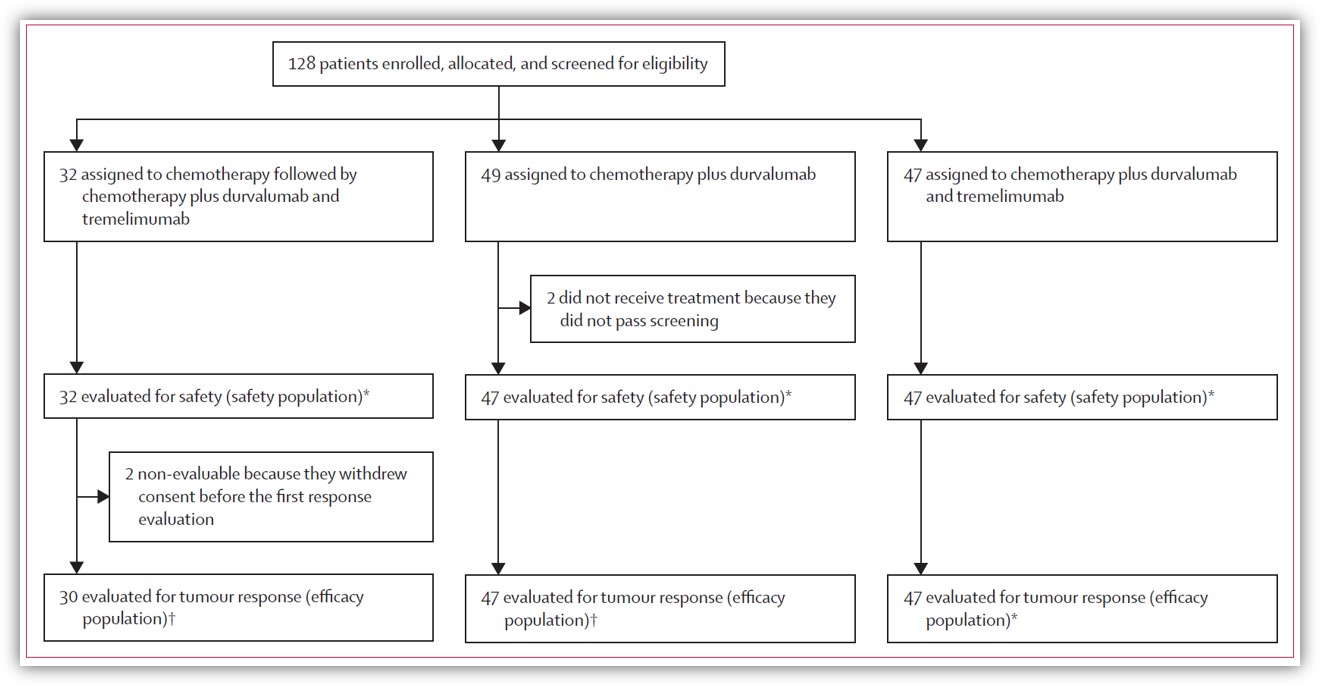
研究表明英飞凡联合替西木单抗联合吉西他滨和顺铂展现了良好的疗效和可接受的安全性。在疗效方面,总体客观缓解率(ORR)为66%(82/124),在C/C+D+T组、C+D组和C+D+T组ORR分别为50%(15/30)、72%(34/47)和70%(33/47)。总体疾病控制率为98%(122/124),在C/C+D+T组、C+D组和C+D+T组分别是97%(N=29)、100%(N=47)和98%(N=46)。总体中位缓解时间为9.8月,中位无进展生存期(mPFS)为12.1月,中位总生存期(mOS)18.4个月。C/C+D+T组、C+D组和C+D+T组的mPFS分别为12.8月、11.8月和12.3月,中位OS分别为11.8月、15.0月(10.7-19.2)、20.2月(12.8-27.6)和18.7月(14.1-23.2)。患者总体及各治疗组的缓解率和mPFS都优于之前单独使用化疗[1,2]或免疫治疗联合化疗[3,4,5]的报道。在安全性方面,没有发生率高于10%的免疫介导的不良反应,也没有患者因不良反应死亡或停药。该临床试验数据为阿斯利康开发的英飞凡结合替西木单抗的免疫疗法用于晚期胆道肿瘤一线治疗提供了强有力的循证医学证据;该研究同时也全面探究了可能作为联合治疗疗效预测的分子标志物。
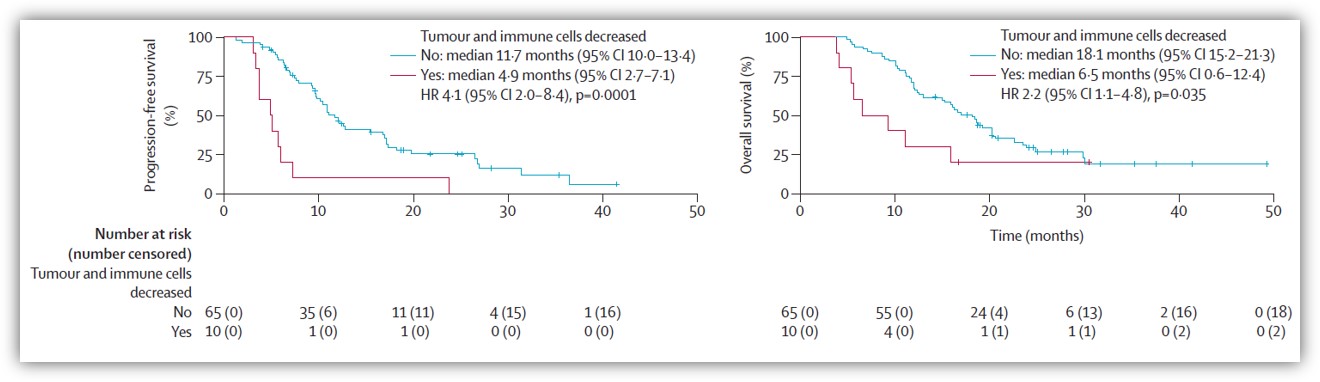
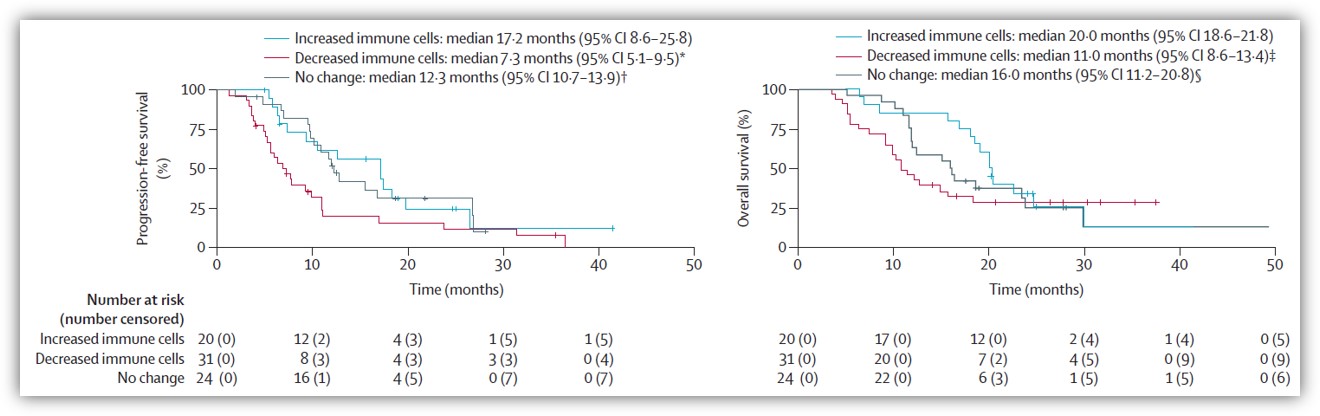
研究者首次评估了胆道肿瘤中免疫联合疗法后的PD-L1表达变化以及与预后的相关性。入组时共有118患者接受了PD-L1免疫组化分析,其中36例(31%)患者的肿瘤细胞PD-L1表达阳性(≥1%)、73例(62%)患者的免疫细胞PD-L1表达阳性(≥1%)。研究发现基线PD-L1表达水平与临床预后并没有相关性,但一个治疗周期后肿瘤细胞和免疫细胞中PD-L1表达的下降与PFS(p=0.0001)和OS(p=0.035)的缩短相关。其中,免疫细胞中PD-L1表达增加或不变的患者的PFS比免疫细胞中PD-L1表达下降的患者的更长。
研究者利用组织样本探究了肿瘤突变负荷(TMB)、微卫星不稳定(MSI)、基因突变等潜在生物标志物与预后之间的相关性。各组患者的中位TMB处于2.15-2.52突变/Mb之间,约有6%(5/87)样本的TMB≥11.13突变/Mb。然而研究者并未观察到TMB与疗效之间的相关性。在1例(2%,52)患者中检测到MSI,该患者获得部分缓解。基因突变方面,在C+D组和C+D+T组,最常见的突变基因分别是TP53、KRAS、CDKN2A、CDKN2B和ARID1A。生存分析显示在C+D组,ARID1A基因突变与PFS短相关;而在C+D+T组中,CDNK2A基因突变与PFS短相关。
研究者采用慧渡医疗新一代液态活检PredicineATLAS™检测患者ctDNA的变化,分析突变结果与患者预后之间的相关性。研究发现在两个治疗周期后,在客观缓解的C+D组和C+D+T组患者中,分别在72%(21/29)和80%(12/15)患者中检出血浆中ctDNA突变丰度的降低。而治疗后观察也显示,客观缓解的患者的ctDNA突变丰度显著低于未缓解的患者(p=0.014),提示治疗后的ctDNA突变丰度或可作为评估免疫治疗联合化疗疗效的生物标志物。
目前慧渡医疗与全球前十名的国际药企进行临床合作研究,多篇文章发表在European Urology 等影响因子达20分的国际顶级学术期刊。通过全球范围的合作,慧渡医疗基于血液、尿液和组织的新一代基因检测技术在新药临床试验、个体化医疗和癌症早筛等领域发挥了积极作用,通过建立智慧医学大数据平台赋能精准医疗。慧渡医疗助力肿瘤新药创新,引领泌尿生殖系统肿瘤的精准新药开发。
点击查看慧渡医疗与AstraZeneca更多合作:
*ASCO21 | 慧渡医疗和AstraZeneca联合报道液态活检预测胰腺癌的免疫治疗疗效研究
*ASCO-GI 2021 | 慧渡医疗携手CCTG和AstraZeneca发布血液TMB预测胰腺癌联合免疫治疗的临床研究
*SITC 2020 | 慧渡医疗三度携手阿斯利康、建立bTMB液态活检行业对照标准
*ESMO 2020 | 慧渡医疗再次携手阿斯利康、液态活检助力肿瘤免疫临床试验
*ASCO20 | 阿斯利康携手慧渡医疗,液态活检助力新药临床试验
References:
[1] OkusakaT, Nakachi K, Fukutomi A, et al. Gemcitabine alone or in combination with cisplatin in patients with biliary tract cancer: a comparative multicentre study in Japan. Br J Cancer 2010; 103: 469–74.
[2] ValleJ, Wasan H, Palmer DH, et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med 2010; 362: 1273–81.
[3] SunD, Ma J, Wang J, et al. Anti-PD-1 therapy combined with chemotherapy in patients with advanced biliary tract cancer. Cancer Immunol Immunother 2019; 68: 1527–35.
[4] UenoM, Ikeda M, Morizane C, et al. Nivolumab alone or in combination with cisplatin plus gemcitabine in Japanese patients with unresectable or recurrent biliary tract cancer: a non- randomised, multicentre, open-label, phase 1 study. Lancet Gastroenterol Hepatol 2019; 4: 611–21.
[5] FengK, Liu Y, Zhao Y, et al. Efficacy and biomarker analysis of nivolumab plus gemcitabine and cisplatin in patients with unresectable or metastatic biliary tract cancers: results from a phase II study. J Immunother Cancer 2020; 8: e000367.
